Si pinchas este ling encontraras una variedad de experimentos que puedes realizar en casa para que comprendas mejor cada reacción químicas
http://www.cienciafacil.com/
Música
sábado, 20 de agosto de 2011
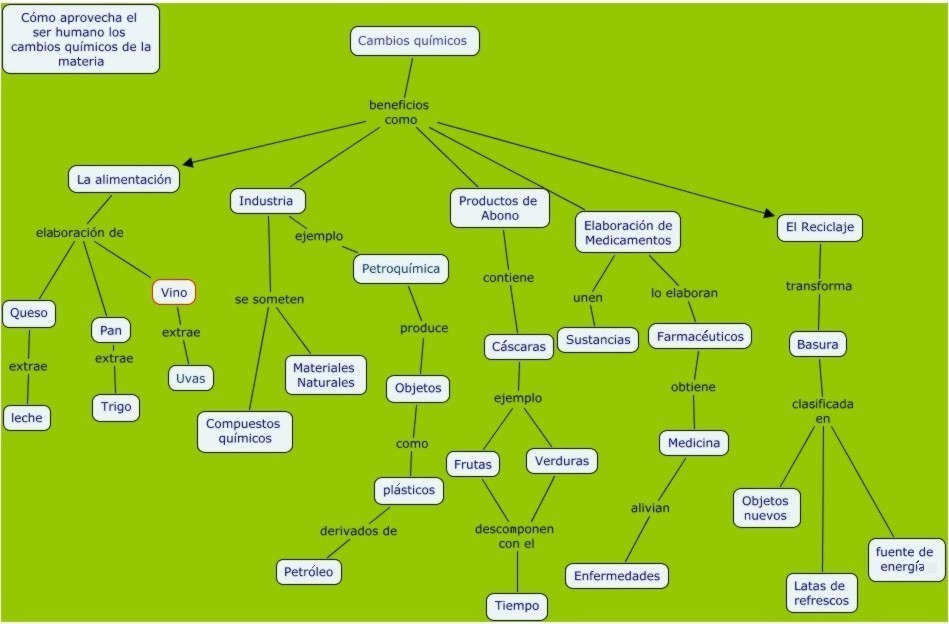
Aprendiendo por medio de la experimentación
viernes, 19 de agosto de 2011
martes, 16 de agosto de 2011
TIPOS DE REACCIONES QUÍMICAS
http://www.cespro.com/Materias/MatContenidos/Contquimica/QUIMICA_INORGANICA/reacciones_quimicas.htm
Las ecuaciones químicas son expresiones abreviadas de los cambios o reacciones químicas en términos de los elementos y compuestos que forman los reactivos y los productos se clasifican en:
Las ecuaciones químicas son expresiones abreviadas de los cambios o reacciones químicas en términos de los elementos y compuestos que forman los reactivos y los productos se clasifican en:
NOMBRE | EXPLICACIÓN | EJEMPLO | ||||||
| Composición o síntesis | Es aquella donde dos o más sustancias se unen para formar un solo producto |
| ||||||
| Descomposición o análisis | Ocurre cuando un átomo sustituye a otro en una molécula : |
| ||||||
| Neutralización | En ella un ácido reacciona con una base para formar una sal y desprender agua. |
| ||||||
| Desplazamiento | Un átomo sustituye a otro en una molécula |
| ||||||
| Intercambio o doble desplazamiento | Se realiza por intercambio de átomos entre las sustancias que se relacionan |
| ||||||
| Sin transferencia de electrones | Se presenta solamente una redistribución de los elementos para formar otros sustancias. No hay intercambio de electrones. | Reacciones de doble desplazamiento | ||||||
| Con transferencia de electrones (REDOX) | Hay cambio en el número de oxidación de algunos átomos en los reactivos con respecto a los productos. | Reacciones de síntesis, descomposición, desplazamiento | ||||||
| Reacción endotérmica | Es aquella que necesita el suministro de calor para llevarse a cabo. |
| ||||||
| Reacción exotérmica | Es aquella que desprende calor cuando se produce. |
|
LA ECUACIÓN QUÍMICA
http://www.cespro.com/Materias/MatContenidos/Contquimica/QUIMICA_INORGANICA/reacciones_quimicas.htm
En la ecuación química los números relativos de moléculas de los reaccionantes y de los de los productos están indicados por los coeficientes de las fórmulas que representan estas moléculas.
| HCl | + reactivos | NaOH | → | NaCl | + productos | H2O |
características de la ecuación:
1. Indica el estado físico de los reactivos y productos ((l) liquido, (s) sólido, (g) gaseoso y (ac) acuoso (en solución) )
2. Deben indicarse los catalizadores que son sustancias que aceleran o disminuyen la velocidad de la reacción y que no son consumidos. Estos van encima o debajo de la flecha que separa reactantes y productos.
EJEMPLO:
| 6CO2 | + | 6H2O | → luz solar | C6H12O6 | + | 6O2 |
3. Debe indicarse el desprendimiento o absorción de energía
4. La ecuación debe estar balanceada, es decir el número de átomos que entran debe ser igual a los que salen
EJEMPLO:
EJEMPLO:
| 2H(g) | + | O2(g) | → | 2H2O (l) | + | 136 kcal |
5. Si hay una delta sobre la flecha  indica que se suministra calor a la reacción;
indica que se suministra calor a la reacción;
EJEMPLO:
| KClO3 | KCl | + | O2 |
¿Que son las reacciones Quimicas?
Una reacción química es el proceso por el cual unas sustancias se transforman en otras .
EJEMPLO: El H2 y el O2 reaccionan para formar un nuevo compuesto H2O.
las sustancias iniciales se llaman reactivos o reactantes y las que resultan se llaman productos.
http://www.cespro.com/Materias/MatContenidos/Contquimica/QUIMICA_INORGANICA/reacciones_quimicas.htm
sábado, 13 de agosto de 2011
Reacciones químicas
Las reacciones químicas se pueden distinguir entre cambio o fenómenos físicos y químicos.
Los cambios químicos, en el cual se modifica la naturaleza de las sustancias que intervienen se conocen como reacción química. En ellas encontramos los reactivos que son las sustancias que están antes de que ocurra la reacción química, después de ocurrida la reacción química encontramos los productos.
lunes, 11 de julio de 2011
“Es necesario, pues que recapacites que hay un mundo, del cual formas parte, y que este universo se halla regido por un Ser supremo, cuya esencia se refleja en tu espíritu, y que tu vida está estrechamente circunscrita al tiempo. Por lo tanto, si no lo aprovechas para buscar la tranquilidad de tu alma, desaparecerá contigo y ya no podrás lograrlo”.
Suscribirse a:
Entradas (Atom)